$\newcommand{\dede}[2]{\frac{\partial #1}{\partial #2} }
\newcommand{\dd}[2]{\frac{d #1}{d #2}}
\newcommand{\divby}[1]{\frac{1}{#1} }
\newcommand{\typing}[3][\Gamma]{#1 \vdash #2 : #3}
\newcommand{\xyz}[0]{(x,y,z)}
\newcommand{\xyzt}[0]{(x,y,z,t)}
\newcommand{\hams}[0]{-\frac{\hbar^2}{2m}(\dede{^2}{x^2} + \dede{^2}{y^2} + \dede{^2}{z^2}) + V\xyz}
\newcommand{\hamt}[0]{-\frac{\hbar^2}{2m}(\dede{^2}{x^2} + \dede{^2}{y^2} + \dede{^2}{z^2}) + V\xyzt}
\newcommand{\ham}[0]{-\frac{\hbar^2}{2m}(\dede{^2}{x^2}) + V(x)}
\newcommand{\konko}[2]{^{#1}\space_{#2}}
\newcommand{\kokon}[2]{_{#1}\space^{#2}} $
# Lektion
## Vereinfachungen
### Kubisch-Quadratisch-Linear:
Wir verwenden meist die quadratische Approximation dh. wir vernachlässigen meist einen Parameter.
#### Beispiel 1:
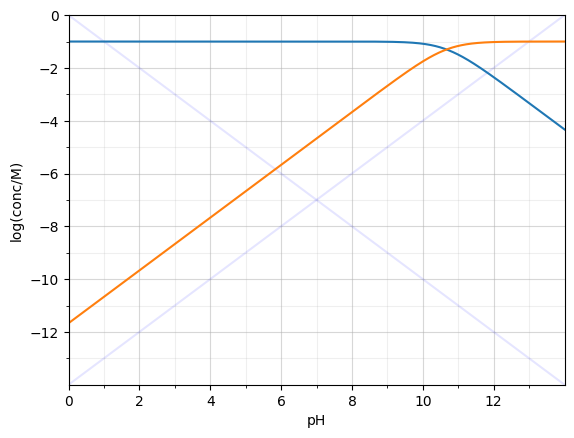
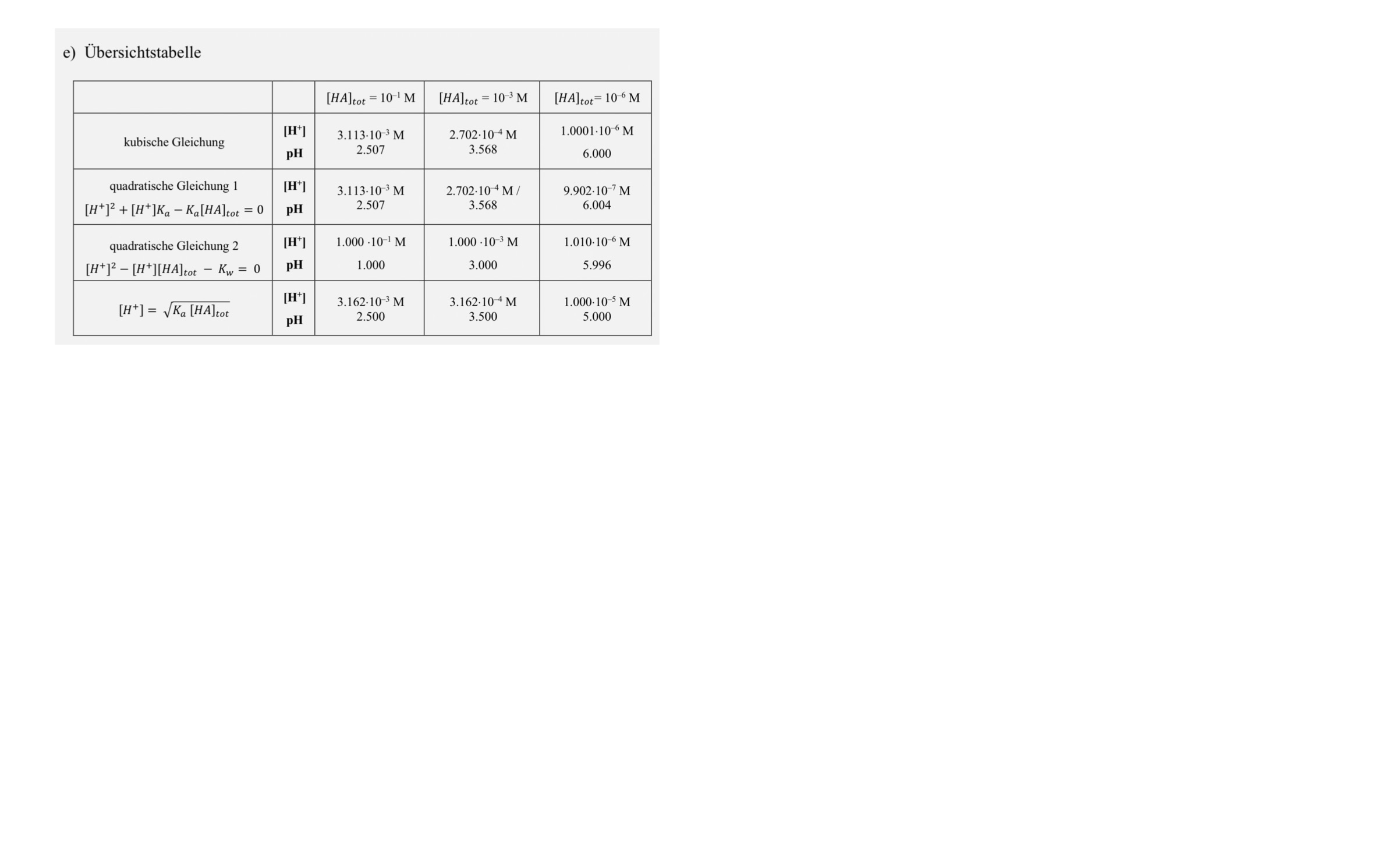
$0.1 M$ Heptylamin (B) ($pKa=10.67$)
I: $K_{b}=\ce{\frac{[BH+][OH-]}{[B]}}$
II: $\ce{[OH-] = [H+] + [BH+]}$
- Relativ hohe Konzentration an Base
- $\ce{[OH-]}$ kommt von Base
- II -> III: $\ce{[OH-] \approx [BH+]}$
IV: $\ce{[B_{zg}]= [B] + [BH+]}$
IV + II -> V:
$\ce{[B_{zg}] - [OH-] = [B]}$
V + I + II -> VI:
$K_{b}= \frac{[OH-]^{2}}{[B_{zg}] - [OH-]}$
$\ce{[OH-]^{2} + [OH-]K_{b} - K_{b}[B_{zg}] = 0}$
$\ce{[OH-]= \frac{1}{2}( -K_{b} + \sqrt{K_{b}^{2} + 4 K_{b}[B_{zg}]}})$
$\ce{[OH-]} \approx 6.61\cdot10^{-3}$
$pOH=2.18$
$pH = 11.82$
 #### Beispiel 2:
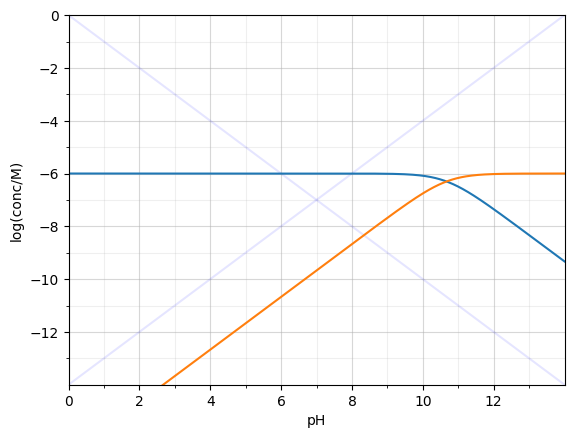
$1\cdot 10^{-6} M$ Heptylamin (B) ($pKa=10.67$)
I: $K_{b}=\ce{\frac{[BH+][OH-]}{[B]}}$
II: $\ce{[OH-] = [H+] + [BH+]}$
III: $\ce{[B_{zg}]= [B] + [BH+]}$
Sehr wenig Base -> Basically vollständige Dissozation
$\ce{[B]\approx 0}$
III -> IV: $\ce{[B_{zg}]=[BH+]}$
II+IV -> V: $\ce{[OH-] = [H+] + [B_{zg}]}$
10x Mehr Heptylamin als $10^{-7}$ $\ce{[H+]}\approx 0$
VI: $\ce{[OH-]=[B_{zg}]}$
$pOH = -\log([B_{zg]}) = 6$
$pH = 14-6=8$
#### Beispiel 2:
$1\cdot 10^{-6} M$ Heptylamin (B) ($pKa=10.67$)
I: $K_{b}=\ce{\frac{[BH+][OH-]}{[B]}}$
II: $\ce{[OH-] = [H+] + [BH+]}$
III: $\ce{[B_{zg}]= [B] + [BH+]}$
Sehr wenig Base -> Basically vollständige Dissozation
$\ce{[B]\approx 0}$
III -> IV: $\ce{[B_{zg}]=[BH+]}$
II+IV -> V: $\ce{[OH-] = [H+] + [B_{zg}]}$
10x Mehr Heptylamin als $10^{-7}$ $\ce{[H+]}\approx 0$
VI: $\ce{[OH-]=[B_{zg}]}$
$pOH = -\log([B_{zg]}) = 6$
$pH = 14-6=8$
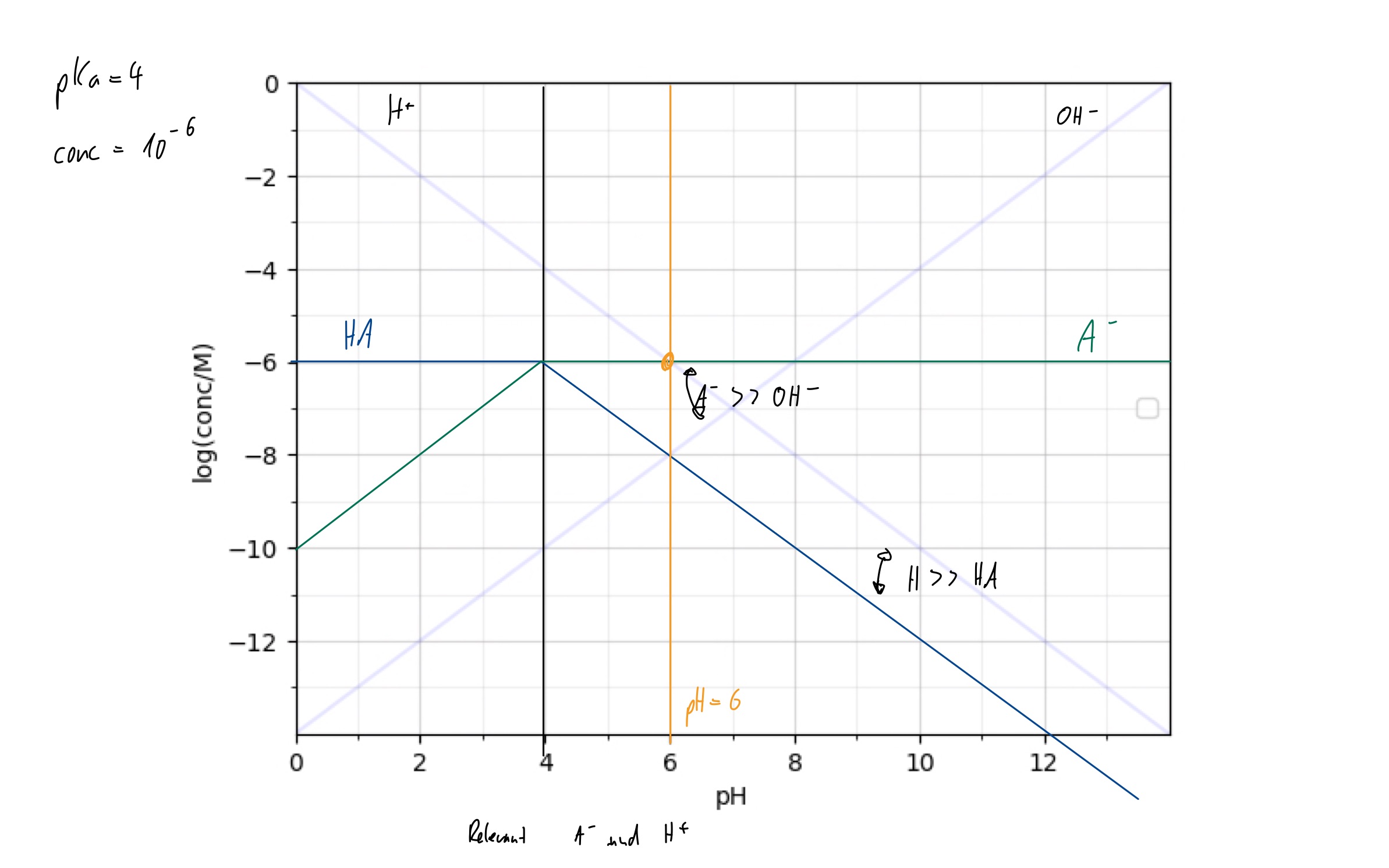
 ## Verteilungsdiagramme
(nicht super relevant)
Wann ist was vorhanden? Kreuzung bei pKa (why? => Gleich viel im mwg einsetzen tada!)
Mehrere pKas!
Nahe Existenzgebiete
(Mittelung der pH’s)
## Puffer:
Säure bzw Base wird kompensiert via Reaktion:
$\ce{H+_{neu} + A- -> HA}$
$\ce{OH-_{neu} + HA -> A- + H2O}$
Dies funktioniert am besten wenn $[HA] \approx [A^{-}]$
Also bei $pKa=pH$
## Sillén-Diagramme
Aka. **Bjerrum plot** aka. **Hägg diagram**
Idee 1: Linien sind nice, kurven nicht!
Idee 1.1: Schnittpunkte sind einfach zu bestimmen
Idee 1.2: pKa easy ablesbar
Idee 1.3: Vereinfachungen sind super easy
# Umfrage
https://forms.gle/dwXNFKEN23BbasrL7
## Verteilungsdiagramme
(nicht super relevant)
Wann ist was vorhanden? Kreuzung bei pKa (why? => Gleich viel im mwg einsetzen tada!)
Mehrere pKas!
Nahe Existenzgebiete
(Mittelung der pH’s)
## Puffer:
Säure bzw Base wird kompensiert via Reaktion:
$\ce{H+_{neu} + A- -> HA}$
$\ce{OH-_{neu} + HA -> A- + H2O}$
Dies funktioniert am besten wenn $[HA] \approx [A^{-}]$
Also bei $pKa=pH$
## Sillén-Diagramme
Aka. **Bjerrum plot** aka. **Hägg diagram**
Idee 1: Linien sind nice, kurven nicht!
Idee 1.1: Schnittpunkte sind einfach zu bestimmen
Idee 1.2: pKa easy ablesbar
Idee 1.3: Vereinfachungen sind super easy
# Umfrage
https://forms.gle/dwXNFKEN23BbasrL7



 #### Beispiel 2:
$1\cdot 10^{-6} M$ Heptylamin (B) ($pKa=10.67$)
I: $K_{b}=\ce{\frac{[BH+][OH-]}{[B]}}$
II: $\ce{[OH-] = [H+] + [BH+]}$
III: $\ce{[B_{zg}]= [B] + [BH+]}$
Sehr wenig Base -> Basically vollständige Dissozation
$\ce{[B]\approx 0}$
III -> IV: $\ce{[B_{zg}]=[BH+]}$
II+IV -> V: $\ce{[OH-] = [H+] + [B_{zg}]}$
10x Mehr Heptylamin als $10^{-7}$ $\ce{[H+]}\approx 0$
VI: $\ce{[OH-]=[B_{zg}]}$
$pOH = -\log([B_{zg]}) = 6$
$pH = 14-6=8$
#### Beispiel 2:
$1\cdot 10^{-6} M$ Heptylamin (B) ($pKa=10.67$)
I: $K_{b}=\ce{\frac{[BH+][OH-]}{[B]}}$
II: $\ce{[OH-] = [H+] + [BH+]}$
III: $\ce{[B_{zg}]= [B] + [BH+]}$
Sehr wenig Base -> Basically vollständige Dissozation
$\ce{[B]\approx 0}$
III -> IV: $\ce{[B_{zg}]=[BH+]}$
II+IV -> V: $\ce{[OH-] = [H+] + [B_{zg}]}$
10x Mehr Heptylamin als $10^{-7}$ $\ce{[H+]}\approx 0$
VI: $\ce{[OH-]=[B_{zg}]}$
$pOH = -\log([B_{zg]}) = 6$
$pH = 14-6=8$
 ## Verteilungsdiagramme
(nicht super relevant)
Wann ist was vorhanden? Kreuzung bei pKa (why? => Gleich viel im mwg einsetzen tada!)
Mehrere pKas!
Nahe Existenzgebiete
(Mittelung der pH’s)
## Puffer:
Säure bzw Base wird kompensiert via Reaktion:
$\ce{H+_{neu} + A- -> HA}$
$\ce{OH-_{neu} + HA -> A- + H2O}$
Dies funktioniert am besten wenn $[HA] \approx [A^{-}]$
Also bei $pKa=pH$
## Sillén-Diagramme
Aka. **Bjerrum plot** aka. **Hägg diagram**
Idee 1: Linien sind nice, kurven nicht!
Idee 1.1: Schnittpunkte sind einfach zu bestimmen
Idee 1.2: pKa easy ablesbar
Idee 1.3: Vereinfachungen sind super easy
# Umfrage
https://forms.gle/dwXNFKEN23BbasrL7
## Verteilungsdiagramme
(nicht super relevant)
Wann ist was vorhanden? Kreuzung bei pKa (why? => Gleich viel im mwg einsetzen tada!)
Mehrere pKas!
Nahe Existenzgebiete
(Mittelung der pH’s)
## Puffer:
Säure bzw Base wird kompensiert via Reaktion:
$\ce{H+_{neu} + A- -> HA}$
$\ce{OH-_{neu} + HA -> A- + H2O}$
Dies funktioniert am besten wenn $[HA] \approx [A^{-}]$
Also bei $pKa=pH$
## Sillén-Diagramme
Aka. **Bjerrum plot** aka. **Hägg diagram**
Idee 1: Linien sind nice, kurven nicht!
Idee 1.1: Schnittpunkte sind einfach zu bestimmen
Idee 1.2: pKa easy ablesbar
Idee 1.3: Vereinfachungen sind super easy
# Umfrage
https://forms.gle/dwXNFKEN23BbasrL7




